高分子溶液
高分子溶液
溶液:溶质+溶剂
- 气态溶液(混合气体)
- 液态溶液
- 固态溶液(如合金)
高分子溶液:高聚物以分子状态分散在溶剂中所形成的均相混合物,热力学上稳定的二元或多元体系
- 未硫化的天然橡胶(生胶)+汽油,苯、甲苯
- HDPE+四氢萘
- 聚乙烯醇+水
高分子溶液的用途
- 稀溶液(C<1%):例如分子量测定
- 热力学性质的研究
- 动力学性质的研究(溶液的沉降,扩散,粘度等)
- 高分子在溶液中的形态尺寸(柔顺性,支化情况 等)研究其相互作用(包括高分子链段间,链段与溶剂分子间的相互作用)
- 测量分子量,分子量分布,测定内聚能密度,计算 硫化胶的交联密度等
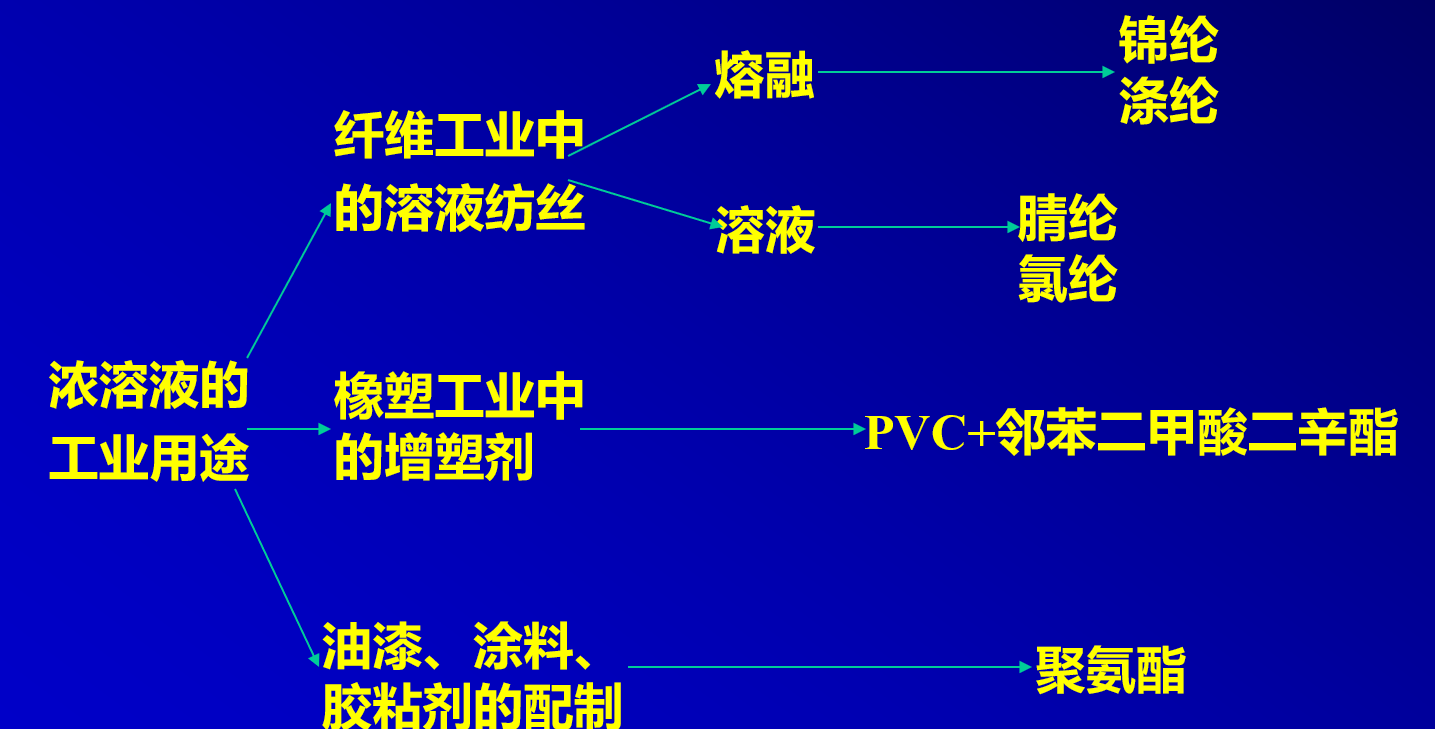
- 浓溶液(C>5%):纺丝、油漆、胶粘剂、增塑
浓溶液和稀溶液最本质的区别:稀溶液中单个大分子链线团是孤立存在的,相互之间没有交叠;而在浓厚体系中,大分子链之间发生聚集和缠结。
¶高分子的溶解
¶溶解过程
- 小分子溶解:溶质向溶剂中扩散
- 高分子溶解:
- 线形无定形高分子
- 混合初期:单项扩散,溶胀
- 混合后期:双向扩散,溶解
-

- 线形结晶高分子——先溶胀无定形区,在晶体熔点附近的温度使晶体解体后溶解
- URL 瑙g爜
- :不溶胀**
- 线形无定形高分子
¶溶剂的选择
-
极性相近

-
溶剂化作用——具有相异电性的两种基团,极性强弱越接近,彼此间相互作用越强、结合力越大。

溶剂-高分子相互作用>高分子-高分子间相互作用
- 内聚能密度或溶度参数相近

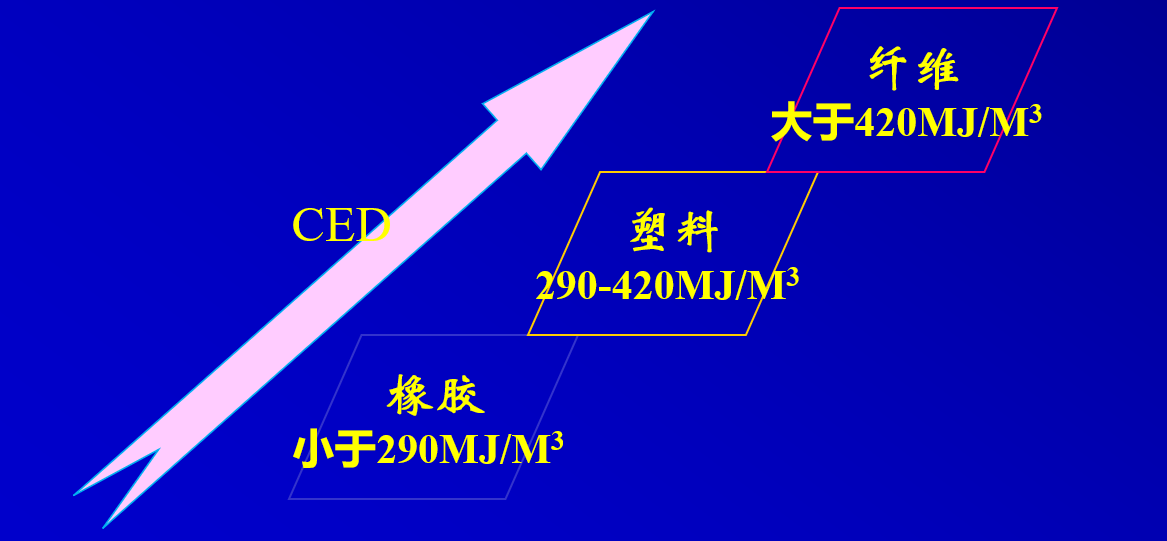
溶度参数是具有加和性的
选择同高分子溶质溶度参数相近的溶剂通常有利于溶解

真实的溶解情况需要将三种因素综合考虑
- PAN**(聚丙烯腈、强极性):包括合成纤维(如腈纶,也称人造羊毛)。溶于DMF(二甲基甲酰胺)、乙腈(强极性),但不溶解于与它δ值相近的乙醇、甲醇等。因为PAN极性很强,而乙醇、甲醇等溶剂极性太弱。
- ** **PS(聚苯乙烯、弱极性):**脆性塑料。溶于甲苯、氯仿、苯胺(弱极性)和苯(非极性)。不能溶解在与它δ值相近的丙酮中,因为PS弱极性,而丙酮强极性。
¶热力学分析
-
极性高分子+极性溶液
- 溶解放热,
- 溶解放热,
-
非极性溶液——Hildebrand公式
-
-
¶练习题

¶高分子溶液的热力学理论
二元混合体系中两种分子中各含
| 溶液 |
|
|
|---|---|---|
| 小分子溶液 | 1 | 1 |
| 高分子溶液 | 1 | x |
| 高分子共混 |
|
|
理想溶液的热力学性质
¶Flory-Huggins理论
基本假定:
- i.溶液体系虚拟为似晶格结构。一个溶剂分子占一个晶格,一个高分子分为x 个链段、占x 个相连的晶格。
- ii.等几率。溶剂与链段占某个任选格子的几率正比于其在体系中的分数。
- iii.等构象能。高分子链构象能相等。
¶混合熵
混合体系中溶剂分子的体积分数为
¶混合焓、 混合自由能
混合焓:
Flory-Huggins相互作用参数:高分子与溶剂混合过程中相互作用能的变化
| 溶剂类型 |
|
|
|---|---|---|
| 良溶剂 |
|
|
| 无热溶剂 |
|
|
| 亚良溶剂 |
|
|
混合自由能
¶偏摩尔量
在无限大的溶液体系中加入1摩尔溶质或溶剂引起热力学函数的变化称为偏摩尔量
¶Flory-Krigbaum理论
超量化学位
一维溶胀因子
-
-
-
此时的溶液称为Θ 溶液, 溶剂称为Θ 溶剂达到Θ 条件的温度称为Θ 温度,具有以下性质
¶相平衡
¶渗透压
以
- 良溶剂中,
-
- 不良溶剂中,
¶相分离

¶习题
All articles on this blog are licensed under CC BY-NC-SA 4.0 unless otherwise stated.
Comments